Syntéza a vlastnosti ornithopteranu –
nového člena rodiny porkanů
Jiří Patočka 1 a
František Liška 2
1 Fakulta vojenského zdravotnictví univerzity obrany, Hradec
Králové a Zdravotně sociální fakulta Jihočeské univerzity, České
Budějovice
2 Pedagogická fakulta UK Praha a Vysoká škola
chemicko-technologická Praha
Úvod
Chemie porkanů dnes zahrnuje
řadu neobvyklých struktur, z nichž mnohé připomínají primitivní
dětské obrázky, jiné zase vysoce sofistikované geometrické obrazce a
některé nepřipomínají vůbec nic. Světová rada porkanové
chemie (WCPC) zvažuje zařadit celou skupinu porkanů a jim podobných
struktur do oblasti tzv. "suspicious chemistry", ale
někteří členové výboru to považují za znevážení tohoto
seriozního oboru organické chemie. Je ovšem také pravda, že někteří,
a to dokonce i velmi vážení chemici, považují celou chemii porkanu za úplný
nesmysl a razí pro něj název „preposterous chemistry“. Není naším cílem
dělat arbitra v tomto sporu, ale chtěli bychom na příkladu jedné
takové molekuly ukázat, jak nečekané objevy lze v této oblasti
učinit a jaké možnosti vnáší do chemie porkanů moderní chemické
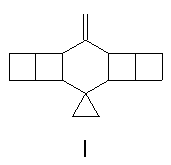
metody. Molekulou o které hovoříme je hexacyklický nenasycený uhlovodík
sumárního vzorce C17H22, nazvaný, ornithopteran (I), chemicky 10-methylidenspiro{
cyklopropan-1,3´-pentacyklo[10.2.0.05,8.04,9.02,11]tetradekan}
(cit.1), zajímavá látka s neméně zajímavými fyzikálními a
chemickými vlastnostmi.
Retrosyntéza
Protože retrosyntéza ornithopteranu
představuje nejzávažnější přínos naší práce, obrátili jsme se na
právní poradnu Světové rady porkanové chemie s dotazem jak nejlépe
ochránit toto naše duševní vlastnictví a průmyslová práva od jejichž
prodeje jsme očekávali v brzké budoucnosti nemalé zisky. Přes
podatelnu na Hlavním nádraží v Praze jsme na jejich radu podali okolkovanou
žádost o přiznání tzv. Evropského patentu a byli jsme rozhodnuti, že pokud
nebude tato příznivě vyřízena, nebudeme poskytovat
vědychtivé odborné veřejnosti žádné bližší informace. Byli jsme
smíření s tím, že to nebude hned, ale poslední vývoj událostí
v oblasti jednotné evropské ochrany inovací a vynálezů ukazuje, že bychom
se toho už také nemuseli dožít 2. Několik let to budou nejprve
diskutovat úředníci v Bruselu a poté co se dohodnou na kompromisním a
téměř nikomu nevyhovujícím řešení, ujme se toho Praha a
vypracuje několik pozměňujících návrhů,(které budou
striktně odmítnuty), takže za příznivých podmínek se může nový
zákon připravovat ještě celá desetiletí. Tato neradostná perspektiva
s námi tak otřásla, že jsme se rozhodli nic neutajovat a naši
retroanalýzu zveřejnit. Uvědomujeme si, že naše jednání je
v rozporu se současnými národními trendy, tj. utajovat vše co se
utajit dá a zejména a především utajovat to co se utajit nedá, ale představa,
že bychom utajované neutajili, tajemství se zmocnil někdo jiný a
publikoval to pod svým jménem, je pro nás prostě nesnesitelná.
Zde je tedy náš původně
utajovaný, ale neutajený návrh na retroanalýzu ornithopteranu a z něj
vycházející návrh na jeho syntézu, který je ale zatím ve stadiu příprav na
sepsání návrhu grantového projektu.
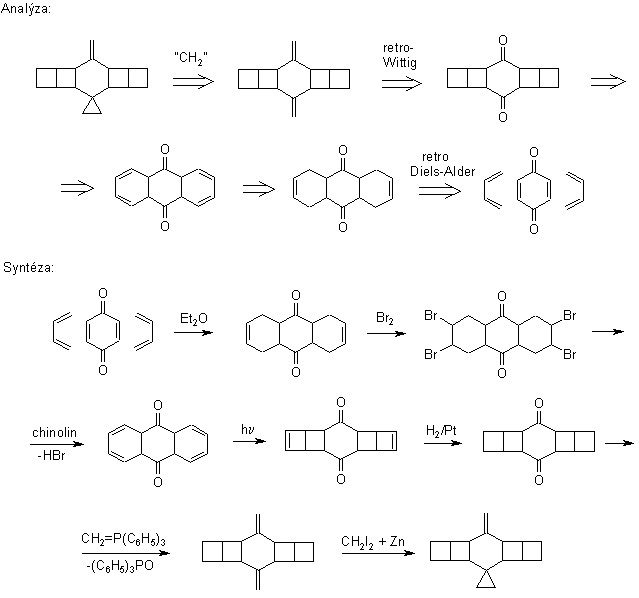
Náš návrh je založen na
retrosyntetické analýze využívající symetrie cílové molekuly. Antitézí se
dospěje ke snadno dostupným výchozím látkám buta-1,3-dienu a
1,4-benzochinonu. Ve směru syntézy se jedná vesměs o jednoduché a
mnohokrát prověřené reakce. Očekáváme proto, že udělení
grantu nebude spojeno se žádnými problémy.
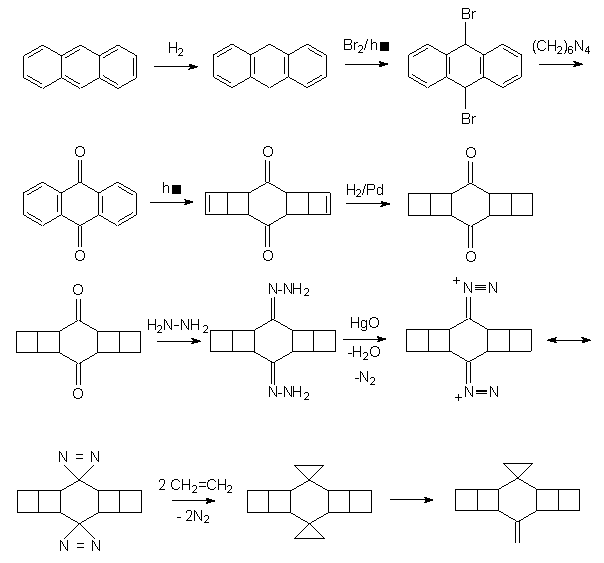
Konkurenční návrh
syntézy vychází z anthracenu: prochází rovněž přes stejný
intermediát – pentacyklo[10.2.0. 05,8. 04,9.02,11]tetradekan-3,10-dion,
ale má řadu nevýhod: je vícestupňový a poskytuje homo-ornithopteran,
molekulu, která je rovněž schopna letu, ale bezhlavého. Není proto vhodná
pro cílené organické syntézy. Podle dobře informovaných zdrojů se
příslušná demethylace doposud nezdařila. Ze všech výše uvedených
důvodů jsme se rozhodli právě tento postup ověřit a
široké chemické veřejnosti tak zpřístupnit zajímavou molekulu vhodnou
ke hraní i ušlechtilé zábavě. Syntézu je navíc možno různě
obměňovat tím, že pružně volíme vhodné suroviny. Nechceme-li
např. utrácet za levný anthracen, koupíme drahý antracit a tento
z něj komplikovaným způsobem izolujeme. Nemáme-li zrovna na
skladě hydrazin, půjčíme si od nějaké snadno dostupné aminokyseliny
aminoskupinu (NH2), překopírujeme ji přes pauzovací papír
a potom oba zrcadlově symetrické antipody spojíme pevným lepidlem. Zkušené
chemiky jistě nemusíme upozorňovat na to, že ani takto okleštěný
zbytek aminokyseliny není nutné vyhazovat, ale lze jej využít k syntéze
jiných zajímavých látek. Podívejme se tedy na to, jaký sled reakcí nás dovedl
ke kýženému produktu.
Opravdová
syntéza
Protože
antracit neviděli v Uhelných skladech již několik let a
v náhradu nám nabízené volně ložené mostecké hnědé uhlí kvality
„ořech“ nebo „pecka“ bylo samý prach a kámen (http://www.znojman.cz/usz/cenik/volne.htm),
zvolili jsme jako výchozí surovinu raději snadno dostupný anthracen. Látka
je na seznamu nebezpečných odpadů (http://www.legis.state.wi.us/rsb/code/nr/nr605_app_iii.pdf)
a možnost změnit ji na něco neškodného se nám jevila vhodnější,
než ji vyhodit do popelnice.
Z anthracenu
jsme potom sledem reakci uvedených v dalším schematu získali konečný
produkt v celkovém výtěžku 6,7 %.
Zbytky nezreagovaného anthracenu v nevábně páchnoucí
reakční směsi jsme analyzovali pomocí GC/MS (http://www.sigmaaldrich.com/Graphics/Supelco/objects/7700/7631.pdf)
a teprve když jsme se přesvědčili, že jeho množství je
ještě o hodně menší než malé, dovolili jsme si vylít obsah nádoby do
kanálu. Poněvadž průměrná cena anthracenu na světových
trzích se pohybuje kolem 6 € za 1 kg, námi vykalkulovaná cena po
přepočtu v tom pro nás nejvýhodnějším kursu a
započítání nezbytných režijních a soukromých nákladů vychází na
1456,67 Kč za 1g ornithopteranu o čistotě větší než 99% a s
obsahem nečistot maximálně do 50%. K této ceně je ovšem
ještě nutno přičíst daň z přidané hodnoty ve výši
19 % pro maloodběratele *
* Maloodběratelům
neprodáváme
Vlastnosti
Ornithopteran je bílá krystalická látka,
nerozpustná ve vodě, ale dobře rozpustná v organických rozpouštědlech.
V úvodu jsme se zmínili o jeho
zajímavých fyzikálních a chemických vlastnostech. V čem je tedy
jeho molekula zajímavá? Je známo, že molekuly nejsou klidové útvary, že chvíli
neposedí, že stále vibrují, rotují a přesouvají se z místa na místo aby
mohly vytvářet různá rotační, vibrační, červená,
fialová a jiná spektra 3. Ale to, co provádí ornithopteran, je
přespříliš. Jeho translační reaktivita je mnohem vyšší než by
odpovídalo jeho molekulárnímu vzorci (C17H22) a
molekulové hmotnosti (226,36). Při této molekulové hmotnosti by se dalo
očekávat, že půjde o usedlou molekulu, ale opak je pravdou. Látka již
při 32 °C sublimuje, tedy při nižší teplotě než kafr (C10H16O,
mol. hm. 152,24). Tato nízká hodnota sublimačního bodu je zřejmě
důvodem, proč se prof. G.A. Dalzoumovi z Nigeru 4 dlouho
nedařilo tuto látku připravit, přestože prý postupoval
přesně podle našeho návodu. Protože průměrná roční
teplota v Niamey za posledních deset let je 43,6 °C 5, nelze se
divit, že reakční nádobka po skončení experimentu byla vždycky
prázdná. Profesor Dalzoum nás jeden čas dokonce podezříval, že jsme
si ornithopteran jen vymysleli. Teprve syntéza provedená v chladírně
místních jatek vedla k úspěchu, ale než se podařilo místní taxi-službě
přemístit lahvičku s produktem z jatek na Univerzitu, byla opět
prázdná. Šetřením na policejní stanici v Niamey-Blabloo se nepotvrdilo
podezření, že s lahvičkou někdo neoprávněně
manipuloval a prof. Dalzoum musel žalobu na neznámého pachatele stáhnout.
Sublimaci ornithopteranu provází
ještě několik dalších zajímavostí. Při pozorování ve
Wilsonově mlžné komoře jsme zjistili, že jeho molekuly se pohybují
mnohem větší rychlostí než by odpovídalo rychlosti Brownova pohybu
při dané teplotě. Naměřený difusní koeficient při
teplotě 323 K měl hodnotu 6,076 ± 0,023 cm.min-1, (průměr ze 14,5
měření), což je asi 260krát vyšší hodnota, než by odpovídala
rychlosti způsobené difusí a také trajektorie dráhy jeho molekul jevila
značné odchylky od bezhlavého pohybu Brownových částic. Dráhy byly buď
přímočaré nebo se jen lehce ohýbaly s koeficientem zakřivení
menším než 0,6 cm2.cm-3 při hladině významnosti
p < 0,0808.
Podobné výsledky byly zaznamenány i při sledování jednotlivých molekul
ornithopteranu v roztoku tetrahydrofuranu
(Sigma-Aldrich, spectrophotometric grade, inhibitor free, CAS 109-99-9)
v bublinkové komoře 6 (First Private Genuine Science and
Progressive High Technology Second Hand, Prague). Difusní koeficient v tomto
prostředí měl hodnotu 4,3809 cm.min-1 (323 K, pouze jedno
měření) a trajektorie molekul ornithopteranu je zřejmá z Obr. 1.
Záhadou zůstává podivné rozdvojení dráhy letu některých molekul,
které si vysvětlujeme tak, že některé molekuly ornithopteranu letí
spolu, držíce se za ruce, ale pak se pustí a letí už každá sama. Podobné dráhy
ornithopteranu jsme viděli ve Wilsonově mlžné komoře.
Alespoň se tak domníváme: ve většině případů byla
totiž mlha v komoře tak silná, že molekuly ornithopteranu v ní bloudily a
bloudily, až se zcela ztratily. Rádi bychom některý z experimentů s Wilsonovou
komorou také dokumentovali přiložením obrázku, ale na fotografiích
kromě mlhy nebylo nic vidět.

Obr.
1. Dráhy molekul ornithopteranu v bublinkové komoře naplněné
tetrahydrofuranem (323 K).
Molekula
ornithopteranu se obvykle pohybuje po přímé, jen lehce zakřivené
dráze. Rozdvojení drah je pravděpodobně způsobeno tím, že
molekuly někdy létají ve dvojicích, pak se ale pustí a dále už letí
samostatně. Opačný jev nebyl pozorován
Mechanická
reaktivita
Protože
ornithopteran při svém divokém letu nevstupuje do žádné chemické reakce
ani v podobě par ani v roztoku, je jasné, že nemůže energii pro
svůj pohyb získávat chemickou reakcí. Proč
tedy ornithopteran tak neúnavně poletuje a kde na to bere energii?
Jediným
rozumným vysvětlením prvé části otázky je, že jej to baví. Je ovšem
nutno zdůraznit, že zvláštní tvar jeho molekuly, připomínající pravěkého ptáka (který mu dal i jméno),
jeho létání vlastně umožňuje. Nebýt této šťastné náhody, nemohl
by létat, i kdyby jej to bavilo sebevíc. Dva postranní cyklobutenové kruhy
umístěné na obou stranách molekuly ornithopteranu mohou vykonávat kmitavý
pohyb podle vazeb mezi uhlíky C3-C4 a C8-C9, připomínající pohyb
ptačích křídel.
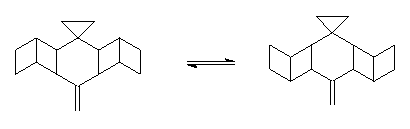

Někdy
ovšem ornithopteran zaujímá prostorovou konformaci při níž má obě
křídla pokroucená, asi takto
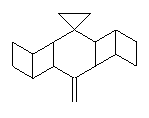
a
potom nejen že nelétá, ale je celý schlíplý a chová se podivně. Měli
jsme takový pocit, že tuto pozici zaujímá tehdy, není-li při svých
leteckých výkonech dostatečně chválen. Neměli jsme však dosud
čas tuto domněnku ověřit.
Tříuhlíkový
spirocyklus v ocasní části molekuly ornithopteranu, otočený
oproti rovině šestičlenného prostředního kruhu o 90
stupňů, funguje jako kormidlo, udržující letící molekulu
v přímém směru. Methylenová skupina na uhlíku 12 vyvažuje
celkovou hmotnost ornithopteranu a udržuje těžiště jeho molekuly
v pozici vhodné pro let. Dostatečným důkazem těchto úvah je
fakt, že nahradíme-li jeden nebo oba vodíky v methylenové skupině
těžším atomem, např. chlorem či bromem, je molekula „těžká
na hlavu“ a její let se mění v krkolomný pád. Zbývá ale ještě
vysvětlit druhou část otázky, tj. kde molekula ornithopteranu bere
energii pro svůj let? Jak už to často bývá, ta
nejnepravděpodobnější varianta bývá často pravdivá. U
ornithopteranu se opět potvrdilo, jak podivuhodné skutečnosti
před námi příroda tají. Molekula ornithopteranu si opatřuje
energii tak, že ji krade svému okolí. Jde tedy o děj protientropický, tedy
velmi nepravděpodobný a proto v nereálném světě porkanů zcela reálný. Krade-li ornithopteran energii potřebnou k pohybu svému
okolí, musí se teplota média v němž poletuje snižovat. Tato naše teorie
byla potvrzena brilantním experimentem, při němž byl roztok
ornithopteranu v CCl3Br umístěn do termosky opatřené
teploměrem a skrytou kamerou. Jak plyne ze zápisu z laboratorního deníku
(Porkany, II-2001d, str. 124) "Teplota se z původních 28 °C
spontánně snižovala a při dosažení hodnoty 15,4 °C, tj. 36 min po
zahájení experimentu, se začala látka z roztoku vylučovat v
podobě drobných hexagonálních krystalů". Zhruba na této
hodnotě se teplota zastavila a již se dále nesnižovala. Převedením
volně poletujících molekul ornithopteranu v roztoku do pevné fáze se
jejich pohyb zastavil a odběr energie z media byl přerušen.
Z
množství pohlceného tepla byla vypočtena změna vnitřní energie DS = - 1560
kJ/mol.
Protože
DH = DS + pDV
a
protože
pDV = DnRT =
W
bylo
již snadné vypočítat reakční teplo (enthalpii) reakce jako
součet standardních slučovacích tepel produktů vynásobených
jejich koeficienty od kterých jsme odečetli součet standardních
slučovacích tepel reaktantů vynásobených jejich koeficienty. Výsledky
měření a odpovídající výpočty budou předmětem
samostatné práce 7, která vhodně navýší počet našich
publikací a pomůže reakreditovat klíčové obory našich škol.
Současně se tím připravujeme na podání žádosti o akreditaci
nového samostatného vědního oboru - chemie porkanu - jehož garanty bychom
se rádi stali za předpokladu, že to bude spojeno s doživotní rentou.
Dlouho
jsme si ovšem lámali hlavu, jaký je mechanismus čerpání energie
z okolí, vedoucí k postupnému snižování teploty média,
v němž se molekuly ornithopteranu pohybují. Problém byl kupodivu
vyřešen vnučkou, jednoho z nás. Když uviděla zvětšený
obrázek molekuly ornithopteranu, ptala se, proč má ten ptáček
vpředu trubičku. Vysvětlení, že nejde o trubičku, ale
schematicky nakreslenou dvojnou vazbu ovšem nepochopila a sveřepě
trvala na tom, že tou trubičkou bumbá jako brčkem. Ve zcela zoufalé
situaci jsme provedli hydrogenaci molekuly ornithopteranu vodíkem na
Rheneyově niklu a nestačili se divit. Se zánikem dvojné vazby nejen
že ornithopteran přestal poletovat, ale přes naši veškerou péči
ztrácel chuť k životu a jeho zdravotní stav se horšil a horšil a
během několika hodin nám pošel, tedy přesněji
řečeno přeměnil se v cosi nedefinovatelného co už ornithopteran
nepřipomínalo ani náhodou.
Lze
ornithopteranu zabránit, aby poletoval?
Neúnavnému poletování ornithopteranu
lze zabránit několika způsoby. Pomineme-li možnost ochlazení
reakční směsi a jeho převedení do krystalické formy, zbývá
ještě vhodná substituce ornithopteranové molekuly. Zcela "nelétavou"
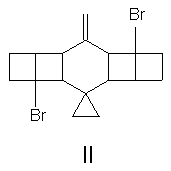
molekulou je např. dibromornithopteran (II). Jinou možností jak omezit
či dokonce zcela znehybnit molekulu ornithopteranu je způsob, který
jsme pracovně nazvali "podvaz křídla" (wing ligature; pinion ligature). Ten
může být buď jednostranný (pravostranný, III či levostranný, IV)
nebo i oboustranný (V). Výsledky naší práce lze dobře sledovat na chování
výše uvedených molekul v bublinkové komoře (Obr. 2).
Molekula
ornithopteranu se obvykle pohybuje po přímé, jen lehce zakřivené
dráze (Dráhy 1 až 5). Ve výjimečných případech se jen trochu prolétne
a zase se vrací na místo startu (dráha 6).
Při tzv. "jednostranném podvazu křídla" jde molekula
do vývrtky (pravotočivá spirála smrti) a někde mimo zorné pole kamery
havaruje (dráha 7).
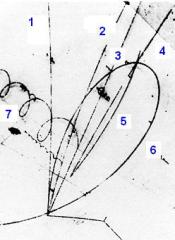
Obr.
2. Dráhy molekul ornithopteranu v bublinkové komoře naplněné
tetrahydrofuranem. Všechny měření probíhala při 323 K a
podmračené obloze.
Dráhy
1 až 5 odpovídají ornithopteranu. Atypická dráha 6 představuje molekulu
ornithopteranu, vracející se po krátkém proletu znovu na start. Může to
být způsobeno tím, že je molekula unavená nebo se něčeho poleká.
Dráha 7 je záznamem letu molekuly látky IV, tedy ornithopteranu s tzv.
"pravostranným podvazem křídla".
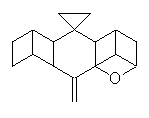
III
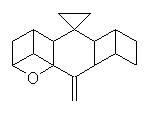
IV
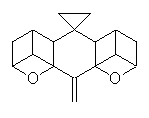
V
Lze
ornithoptaran k něčemu použít?
Jinými
slovy, je nějak užitečný? Domníváme se, užitečný je už tím, že
vůbec existuje. A koho by napadlo, že se bude nějaká chemická
substance chovat tak podivně? Není to okouzlující?
Ale vážně! Využití
molekuly ornithopteranu má velikou budoucnost v oblasti kinetiky reakcí a
enantioselektivních syntéz. Molekula by měla v konformaci křídel
^ létat vzhůru a tak by mohla pomáhat reakčním složkám překonat
tranzitní stav, aniž by se musela snižovat aktivační energie jako je tomu
doposud při aplikaci katalyzátorů.
U reakcí s reaktivními
intermediáty by umožnila měkký přechod z tranzitního stavu do
příslušného minima na křivce potenciální energie, pokud by obě
křídla byla v konformaci V. Konečně, budou-li obě
křídla v konformaci střídavé ^V, je možné, že při letu
z tranzitního stavu střemhlav dolů bude rotovat kolem své osy a
sloučeniny s helikální strukturou budou vznikat
v enantioselektivní formě.
Jinou
otázkou zůstává, zda by nemohl ornithopteran nějak škodit! Jistě
si dovedete představit, že vypuštěním většího množství molekul
ornithopteranu, které okamžitě začnou vysávat energii okolí a tak je
ochlazovat, můžeme zásadním způsobem ovlivnit místní klima. Protože
se má za to, že Země se v poslední době otepluje 8, což je
chápáno jako negativní jev, nemuselo by to však způsobit žádnou větší
katastrofu. Nikdo nebude jistě připravovat ornithopteran v takovém
množství, aby to mohlo mít vliv na ochlazení celé Země či celého
Vesmíru. Ostatně, vzhledem k tomu, že tepelná smrt vesmíru je
zřejmě stejně nevyhnutelná, jen by to trochu uspíšilo jeho
zánik.
Odborně
zneužitá literatura
1 Pro srovnání viz: http://www.5z.com/cchs/porkany/Porkany%20II.htm
2 Dlouholeté dohadování členských zemí EU o
jednotné evropské ochraně inovací a vynálezů naši žádost velmi
komplikuje. Naštěstí předsedající Řecko vypracovalo kompromisní
návrh, který sbližuje stanoviska dosud nesmiřitelných táborů, takže
ledy by se mohly pohnout. Evropská komise podporovaná několika menšími
státy prosazuje, aby kompetentním soudem ve sporech o evropský patent byl
Evropský soudní dvůr (ESD) v Lucemburku. Itálie, Německo a
některé další země by naopak chtěly ustavení kompetentních
národních patentových soudů (byť v konečné instanci
podléhajících Evropskému soudnímu dvoru). Řecko nyní navrhuje, aby v
Lucemburku, při Soudu první instance (součást ESD), vznikl
specializovaný patentový soud, jehož "dvě či více"
decentralizovaných soudních komor by pak mohlo vzniknout v některých
členských státech. Odvolání proti rozhodnutí těchto soudů
(komor) by řešil Soud první instance. Náklady na provoz decentralizované
komory by nesl hostitelský členských stát. Jazykem těchto patentových
soudů by měla být angličtina, francouzština nebo
němčina, přihlášky v jiném oficiálním jazyce EU by musely být
přeloženy společným nákladem žadatele a rozpočtu EU. Naopak
překlad vydaného patentu do ostatních jazyků členských zemí by
byl pouze věcí držitele patentu. Už teď jsme ale rozhodnuti nic
nepřekládat, rozhodně ne na vlastní náklady.
3 Waiser K.: Organická chemie I. Univerzita Karlova v Praze, Nakladatelství Karolinum, Praha 1999, s. 135. ISBN 80-7184-874-3.
4 Université de Niamey, Faculté des Lettres, Département de Sociologie BP 418, Niamey, Niger
5 CLIVAR VACS Variability of the African Climate
System. http://www.clivar.org/organization/africa/vacs.htm
6 http://www.ep.ph.bham.ac.uk/user/watkins/seeweb/BubbleChamber.htm
7 Liška F, Patočka J. Preposterous and nonsensical aviation of ornithopteran molecule in the bubble chamber with liquid tetrahydrofurane and its significancy for down-to-date organic chemistry of 21th century. In preparation.
8 Hecht E. Global warming - Earth's ancient heat wave gives a taste of things to come. New Scientist 176 (2372): 21-21, 2002.
Prof. RNDr. Jiří Patočka, DrSc, DrSc(WC),
jednatel WCPC pro oblast Hradec Králové,
Olomouc a Kábul
a
Prof. Ing. František Liška, CSc.,
prezident názvoslovné komise WCPC
E-Mail: Frantisek.Liska@vscht.cz
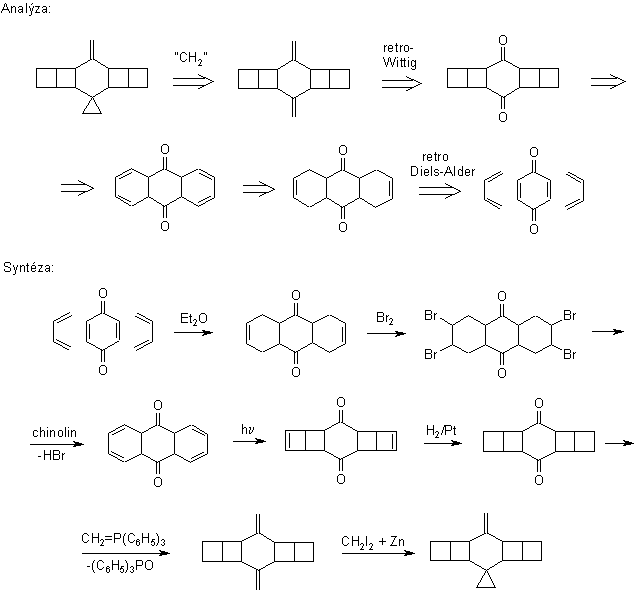
Název I: 10-methylidenspiro{cyklopropan-1,3´-pentacyklo[10.2.0.
05,8. 04,9.02,11]tetradekan}
Náš návrh je založen na retrosyntetické analýze
využívající symetrie cílové molekuly. Antitézí se dospěje ke snadno
dostupným výchozím látkám buta-1,3-dienu a 1,4-benzochinonu. Ve směru
syntézy se jedná vesměs o jednoduché a mnohokrát prověřené reakce.
Konkurenční návrh syntézy vychází
z anthracenu, prochází rovněž přes stejný intermediát –
pentacyklo [10.2.0. 05,8. 04,9.02,11]tetradekan-3,10-dion
(II) má řadu nevýhod: je vícestupňový a poskytuje homo-ornithopteran,
molekulu, která je rovněž schopna letu, ale bezhlavého. Není proto vhodná
pro cílené organické syntézy. Podle dobře informovaných zdrojů se
příslušná demethylace doposud nezdařila.
Využití molekuly ornithopteranu má velikou
budoucnost v oblasti kinetiky reakcí a enatioselektivních syntéz. Molekula
by měla v konformaci křídel ^ létat vzhůru a tak by mohla
pomáhat reakčním složkám překonat tranzitní stav, aniž by se musela
snižovat aktivační energie jako je tomu doposud při aplikaci
katalyzátorů.
U reakcí s reaktivními intermediáty by umožnila
měkký přechod z tranzitního stavu do příslušného minima na
křivce potenciální energie, pokud by obě křídla byla
v konformaci V. Konečně, budou-li obě křídla
v konformaci střídavé ^V, je možné, že při letu z tranzitního
stavu střemhlav dolů bude rotovat kolem své osy a sloučeniny
s helikální strukturou budou vznikat v enantioselektivní formě.